奨学金・授業料免除ってどれくらい受けているの?
こんにちは。ぷにぷにアザラシです。
昨今、学生の経済状況が議論されることをしばしば目にします。「返済不要の奨学金を」「ドイツは授業料はない(?)のに」云々。どれくらいの情報が真実なのかは定かではありませんが、学生の経済状況が良くない、という点に関しては事実なのでしょう。
そこで先日、twitterアカウントにて「学生時代、授業料免除を受けていましたか?また奨学金をもらっていましたか?」というアンケートを採ってみました。以下がその結果です(数字は%)。

(127票、黄:奨学金を受けていた、赤:授業料免除を受けていた)
回答者は私のフォロワーの方が多いと存じますので、博士課程に行っている方の割合が、おそらく世間一般よりも高いことを注記しておきます。
私自身と同じなのですが、「奨学金と授業料免除の両方を受けていた」という方が4割近くで最も多く、おもしろいことに、「授業料免除だけしか受けなかった」人は10%に満ちませんでした。授業料免除を受けられるほどの成績ならば奨学金が何かしら得られるから、なのかも知れません。しかし考え方によっては、授業料免除は、教育を受ける機会の均等化にはあまり貢献していない、とも取れると存じます。奨学金を取れない人に、授業料免除を与える方が、均等化という面では正しいでしょう。確かに、学業優秀な学生に授業料免除の機会を与えるという方策は私も正しいようには感じるのですが。。
博士課程限定ではありますが、文部科学省所管の独立行政法人である日本学術振興会は、学術振興会特別研究員に対してアルバイト等の労働を許容する姿勢を取るようになりました(以前は一切禁止だった)。それだけでも、少なくとも博士学生の経済状況は良くなることでしょう。学部学生に対しても、何かしら(政府であろうと民間団体であろうと)経済的援助を得られるような制度が増えてくると良いですね。
以上となります。
ご意見ございましたら、twitterまたはここにコメント頂けましたら幸いです。
それでは最後まで読んで頂き、ありがとうございました!
薬を運ぶ細胞
こんにちは、ぷにぷにアザラシです。今日は細胞(好中球)を使った、新しい薬の輸送技術(ドラッグデリバリーシステム)について紹介します。
背景
現在使用される医薬品の多くは一度身体の中に入ると、血液を介して全身にくまなく分布します。しかし、脳やガン組織は血管との間に大きな“関門”があり、脳やガン組織の中へは薬が届きにくいことが知られています。今日まで、微小粒子を用いたドラッグデリバリーシステム(NDDS)は数多く開発されてきましたが、微小粒子の安定性や毒性に問題があり、なかなか上手く進んでいませんでした。
そこで登場したのが、細胞を使ったドラッグデリバリーシステム(CDDS)です。当初は、間葉系幹細胞や神経幹細胞と呼ばれる細胞にガン組織への移行性があることを利用して、それらの細胞を用いたドラッグデリバリーシステムの開発が進められてきました。一方で、免疫細胞である好中球にも、炎症反応に呼応して、上記の“関門”を通り抜ける能力があることが知られています。そこで、好中球に薬を“埋め込んで”、ガン組織へ届ける方法も考案されてきました。しかし、好中球が体内で本当にガン組織「だけ」に集まっているのか、誰も知りませんでした。抗がん剤は、いわば毒ですので、健康な組織へ届いてもらっては困ります。そのため、本当に好中球がガン組織に集まっているのか、確認する術が求められていました。
今回の論文のハイライト・展望
今回の主なハイライトは、
- ドキソルビシン(抗がん剤)を封入した磁性ナノ粒子を好中球に入れることに成功した
- MRIを使って、磁性ナノ粒子を持つ好中球の体内での動きを可視化した
- 脳グリオーマモデルマウスの死亡率は、この好中球の投与によって減少した
です。
筆者らは、細胞の動きを見るために、細胞に「黒さび(四酸化三鉄)」を入れたナノ粒子を取り込ませました。そして、黒さびが持つ磁性を利用して、よく医療で用いられるMRIを行い、細胞を可視化することに成功したのです。また、別の実験では、ドキソルビシンそのものがもつ“蛍光”を用いた観察やナノ粒子に蛍光ラベルを施した観察も行っています。さまざまな角度から、この系でのドラッグデリバリーシステムが有効であることがしっかりと証明されています。
ただ、これは炎症反応に反応する系であるため、この論文での抗ガン作用に関する実験は、ガンを手術で取り除いた後に残る「残骸」に対する抗ガン作用を基に評価しています。なので、適応は術的にガン除去を行った後のガンの殲滅、となるでしょう(はじめから使うことはおそらくできない)。脳腫瘍(グリオーマ)は致死性がものすごく高いので、それだけでも価値があるとは思いますが。
この系の良いところは、もちろんその強い抗ガン作用も挙げられますが、臨床現場を考えた場合、投与した後の薬の動向を知ることができることにあるでしょう。特に抗がん剤のような危険な医薬品の場合、望まない場所へ薬が届くことは極力避けるべきですし、もしも届いてしまった場合にはすぐに知る術があるべきでしょう。この手法が臨床現場で使われれば、どこに薬(細胞)があるのか、MRIですぐにわかりますので、そういう意味でも安全に使うことができるかも知れません。
総じて、筆者達のアイデアがふんだんに取り入れられた、とても面白い論文でした。個人的には、この好中球に抗体などを発現させて、ガンに対して標的化し、はじめからガンを殲滅するために使用できるように発展できるのならば、もっと面白くなりそうだと感じました。
以上になります、最後まで読んで下さりありがとうございました!
ミトコンドリアを編集する
ぷにぷにアザラシです。今日はミトコンドリアゲノム編集に成功した以下の2本の論文の背景を解説します!
ミトコンドリアとは
ミトコンドリアとは、細胞の中にある小器官のことで、基本的にはエネルギー(ATP)産生の場として知られています。ミトコンドリアは、太古の昔に、細胞の基となった生物に、ミトコンドリアの基となった生物が共生したことがきっかけで出来上がったという説が有力で、その名残もあって、ミトコンドリアには、細胞とは別の遺伝情報が含まれています。それをミトコンドリアDNAと呼びます。
ミトコンドリアは1つの細胞当たり数十〜数百存在し、1つのミトコンドリアあたり2〜10個程度のミトコンドリアDNAが存在するため、1つの細胞当たり、ミトコンドリアDNAは数十〜数千あるとされています(こんなデータベースもあります)。
ミトコンドリア病とは
ミトコンドリアDNAに載っている情報のほとんどは、エネルギー産生にとても重要なタンパク質(電子伝達系)の作成に関するものです。なので、このミトコンドリアDNAの情報に誤りがあり、誤りのあるミトコンドリアDNAがどんどんと増えてくると、私たちの身体はうまくエネルギーを作れなくなり、病気になります。こうして起きる病気の総称を、ミトコンドリア病と呼び、難病に指定されています(他の原因もあります、詳しくは難病情報センターのこのページを見て下さい)。
新しい遺伝子操作技術
近年、遺伝子(つまりDNA)を操作・編集する技術の革新は凄まじく、昔は半年は最低でもかかっていたといわれる遺伝子改変マウスを、もはや受精卵だけなら2週間で作成できるまでになりました(このメーカーなど)。その驚くべき進歩の背景には、以下のような新しい遺伝子編集技術が開発された経緯があります。
- CRISPR-Cas9
- TALEN
- ZFN
詳しいことは割愛しますが、これらの技術のおかげで、細胞の核にある遺伝情報はかなり編集しやすくなりました。
しかし、ミトコンドリアDNAは核DNAとは違って、同じ遺伝情報が細胞内に非常にたくさんあること、ミトコンドリアの中へ上記技術に必要なタンパク質を送り込むのが難しいことなどから、今まで上記技術をミトコンドリアDNAへ応用した研究はあまりありませんでした。
今回の発見・考察
今回の2つの論文では、ZFNおよびTALENをミトコンドリアへ送り込む技術を開発し、それをミトコンドリア病モデルマウスに用いました。すると、ミトコンドリアDNAへ遺伝子操作を行うことで、ミトコンドリア病が改善するというすばらしい結果を得ることができました。
もちろん、ミトコンドリア病患者に適応するには数々の試練がまだ残されていますが、ミトコンドリア病に対する治療薬は今のところ存在しないため、少し明るい未来が見えたのではないでしょうか?
ミトコンドリア病はまだまだなぜ起きるのかすらわかっていない病気ですので(なぜ誤りのあるミトコンドリアDNAが増えてしまうのか、正しいDNAと誤りのあるDNAをミトコンドリアは区別できているのか、など)、今後そのメカニズムが明らかになってゆくと同時に、上記のような遺伝子治療を臨床でも用いられる日が来ることを、私は楽しみにしています。
以上になります、最後まで読んで下さりありがとうございました!
今の薬剤師の実体(twitterアンケート結果)と考察
こんにちは、ぷにぷにアザラシです。初めて?薬剤師関連の投稿をします。
背景
薬剤師とはご存じの通り、今なら6年間 薬学部で学び、その間に薬局や病院へ実地実習へ行き、研究室で研究をこなし卒業発表をし、国家試験を受験して、合格した人々のことを指します。
あまり知られていませんが、医学部とは違い、薬学部では教育の一環として研究に従事することが定められています。なので、実習などで抜けることを考えても、現行の薬剤師は全員、1年半くらいは研究に従事した経験があるのです(逆に医師の多くは、大学生時代にはあまり研究を経験しない)。おそらく一般の人にとって薬剤師は、最も身近にいる、医療系の研究経験者と言っても間違いではないでしょう。
ただ昨今の薬剤師の立場は、個人的には少しかわいそうな状況にあります。確かにバイタル(心拍や呼吸音など)は取れないけれども、一部とはいえ看護師に薬の扱いで先を越されるような現状*1は、薬のスペシャリストを名乗るのであれば、何とかしないといけないでしょう。
しかし、もちろんただ「処方権が欲しい」と簡単に言うだけではダメでしょう。それ相応の、興味などとは関係のない、覚悟を持った勉強が必要だと私は思います。そういったことを考える中で私に生まれたのは、「薬剤師は本当に勉強が好きなのか」、という問いでした。
そこで先日、以下のようなアンケートを、私のtwitterアカウントを用いて、行ってみたわけです。
- 大学の講義や研究室の実験が好きだったか
- 自分の所属(学生・薬剤師・研究者・その他)
以下にその結果を示します(実際のツイートは末尾に貼ってあります)。
結果
1.に関しては、リツイート等、ご協力頂けたおかげで、527票もの回答を得られました。以下がその結果です。講義が好きな人は全体の28%、研究が好きな人は全体の47%でした。
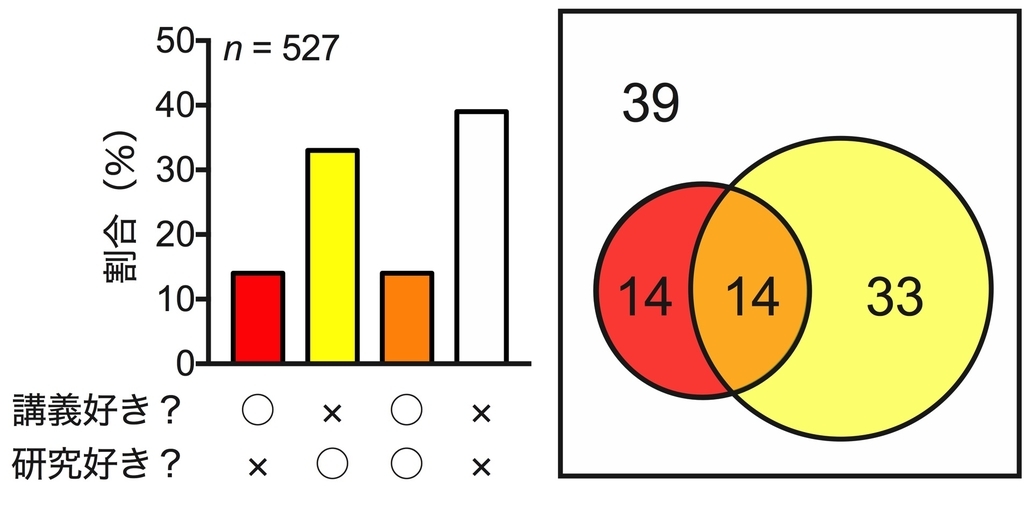
* 色の説明 (グラフもベン図も、同じデータ由来です)*
赤:大学の講義が好き、研究室での研究は嫌い
黄:大学の講義は嫌い、研究室での研究は好き
橙:どちらも好き
白:どちらも嫌い
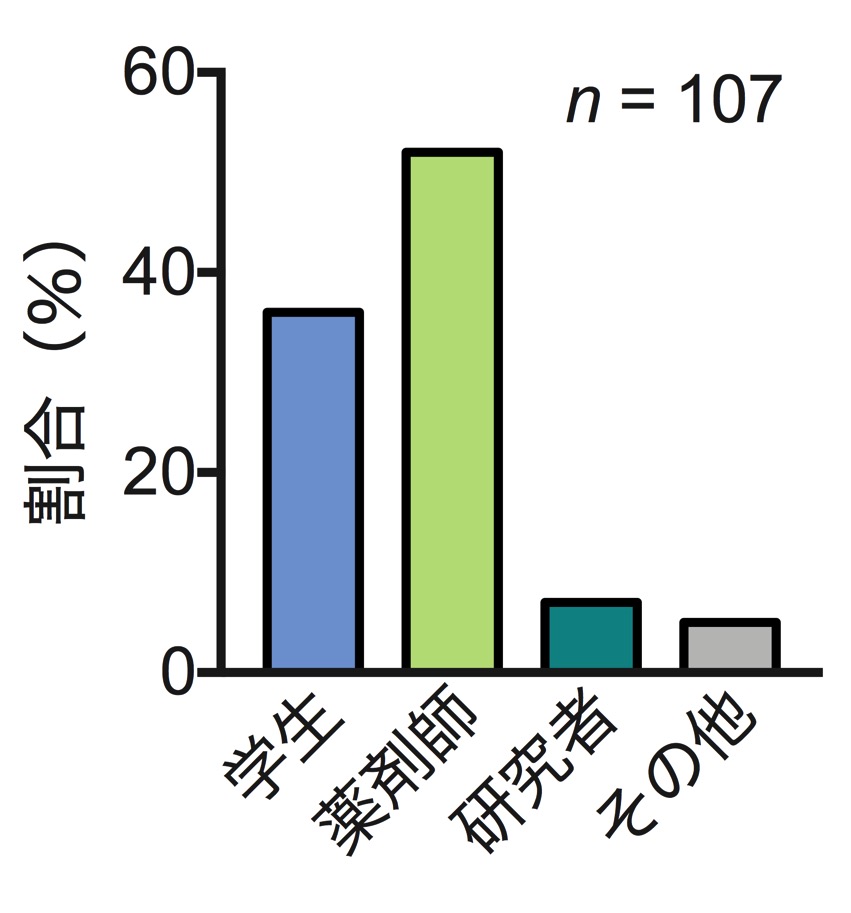
2. に関しては少ししてからツイートを追加したこともあって、107票しかありませんが、ある程度は1. の回答者の所属を反映していると仮定しています。以下に結果を貼ります。
考察・感想
今回のアンケートは、2. の結果より、約半分が薬剤師、約4割が学生でした。なので「薬剤師は本当に勉強が好きなのか」という問いの答えを探るという目的については、該当する薬剤師の回答や、現在勉強中の学生の回答が多いため、ある程度は満たしていると見なします。その上で1. の結果を考察します。
まず、全体の約半分が研究好きと答えたことについて。大学によっては、自分の意思通りに研究室を選べない場所もあるはずですが、それでも半数が研究を好き、と答えたことは、とても良いことだと思います。
しかし問題は講義でしょう。講義が好きな人は全体の3割に満たなかった。個人的にこの結果は、研究に力を入れて講義は手を抜いている大学教員の姿を浮き彫りにしているように感じます。実際の薬剤師業務に必要な知識の多くは、研究室の研究ではなく、大学講義から得られるはずです。そのことを薬学部教員は意識すべきなのかも知れません。これは、私も含め、薬学教育に関わる人間が改心すべきでしょう。
気になったのは、どちらも嫌いな人が4割もいたことです。日本全体の平均的な「勉強の好き嫌い度合い」を私は知りませんので、何とも言えませんが、個人的には予想以上に多いな、と感じました。この人達は上記で指摘したように、希望通りの研究室に入れていれば結果が変わったのか、大学講義がもっと惹きつけるようなものであれば結果が変わったのか、定かではありません。
しかし、twitter上というバイアスのためだとは思いますが、活動的な薬剤師の方に限って、その活動が「副業」のブログでの利益等に傾きがちな現状を見ていて、私は少し悲しく感じています。冒頭で「昨今の薬剤師の立場は、個人的には少しかわいそうな状況にあります」とは書きましたが、副業に専念したいのであれば、今のままでいいのでは?と感じてしまうこともあります。
決して簡単に入れる訳ではない薬学部に入り、ある程度は嫌でも勉強しないと合格できない国家試験に合格した薬剤師の方々の4割が、勉強が嫌いだとは私にはあまり信じられず、現実の残酷さをまざまざと見せつけられた気分でした。
おそらく、看護師のように、医師指導下での処方権を将来得た場合、それを実行するのは病院薬剤師では無く、在宅医療に関わりやすい薬局薬剤師のみなさんでしょう。今後の薬剤師はどうあるべきなのか?この結果を見て少し考えてしまいました。
まだまだ若造で非薬剤師の私が、勝手に思いつくままを書いたまでですので、どうぞこれをたたき台に議論して頂いて構いません。叱咤激励も受け付けます。読み方によっては、大変失礼なことを書いていると私も気付いております。本当に申し訳ございませんでした、この場を借りてお詫び致します。
それでは長文駄文を読んで頂き、本当にありがとうございました。
ps.
当時用いたツイートは以下の通りです。
リツイートして下さった方々、回答して下さった方々、本当にありがとうございます!1日目からこんなに集まるとは思いもしませんでした。
— ぷにぷにアザラシ@アカデミア薬学研究者 (@puni2azarashi) October 15, 2018
もしもよろしければ、回答された方のご所属お伺いしてもよろしいでしょうか?どうぞよろしくお願いいたします。
IgDの正体、見破ったり
こんにちは、ぷにぷにアザラシです。今回はこの論文を紹介します!
(以下画像はリンクです)
背景
私たちの身体が細菌などから身を守るための道具のひとつとして、抗体が挙げられます。抗体とは簡単に言うと以下のような構造のタンパク質で、

基本的には、特定のタンパク質にFab領域でひっついて、Fc領域を使って免疫細胞にひっついて、身体の中の免疫応答を助ける働きをします(他にもありますが割愛)。この、おしりのFcの形によって、抗体は種類分けされるのが普通で、IgM, IgG, IgA, IgE, IgDと 5 種類の抗体が存在することがわかっています。みんな抗体ですが、それぞれ役割が全く違っていて、IgMはある病原体に初めて感染したときに最初に使われますし、IgGは2回目以降に感染したときに迅速に効率よく使われますし、IgAは母乳や唾液など分泌液内で働きますし、IgEはアレルギーの時に力を発揮します。
しかし、IgDに関してはいまいちその役割がよくわかっていませんでした。IgDについて唯一わかっていたことは、IgMと同じような時期に出てくる、ということです(下図)。しかしIgMほどには免疫機能に役立っていないし、最終的には引っ込んでしまうし、なぜ出てくるのか不明だったのです。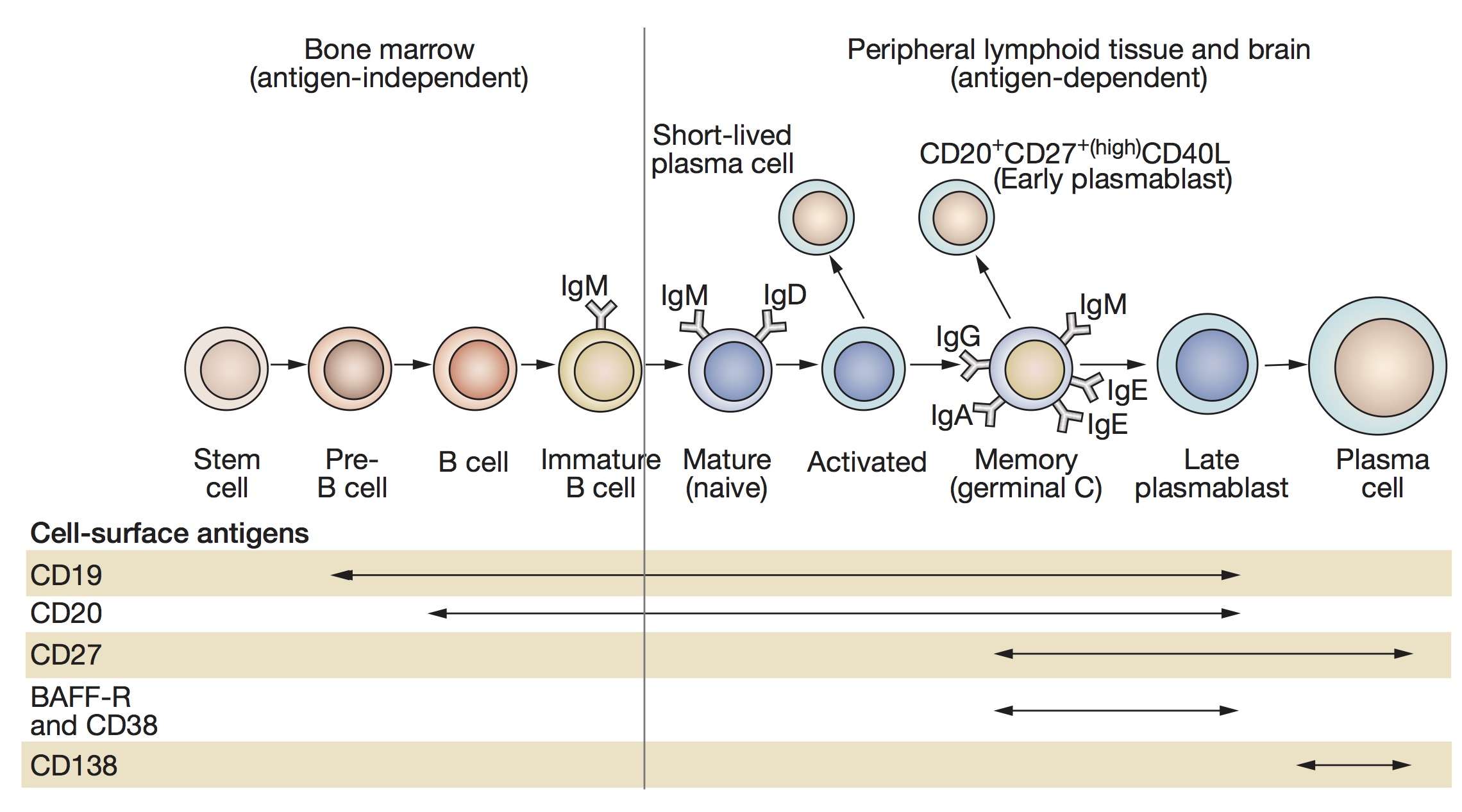
(図:https://www.nature.com/articles/ncpneuro0901より)
今回の研究内容
今回の発見を羅列すると、
- IgD産生は、食物アレルゲンなど水に溶けやすい環境中のアレルゲンで誘導される
- IgDは、好塩基球上のCD44とガレクチン9と呼ばれるタンパクに認識される
- IgDが結合した好塩基球は、Th2誘導サイトカイン(IL4, IL5, IL13)を産生する
- 上記サイトカインで誘導されたTh2細胞は、IgG1およびIgE産生B細胞を誘導する
- IgDが結合した好塩基球は、IgEによって脱顆粒しない(アレルギー誘導しない)
です。一番大きな発見は、2つ目の「CD44とガレクチン9がIgDを認識する」、です。なぜなら、他の4種類の抗体とは違って、IgDを認識するタンパクは今まで発見されていなかったためです。それに加えて、IgDによって起きる体内の免疫応答をしっかりと調べ上げており、さすがはImmunityとしか言いようがありません。
感想
今回の報告で、IgDの認識タンパクが同定されましたので、次はこの認識タンパクを発現している細胞の探索や、その機能評価が行われるでしょう。また、上記発見 4 や 5 にからめて、食物アレルギーの発生機序や、それをどうやって治療すべきかといった知見も今後得られてくるだろうと感じました。食物アレルギーはまだまだ謎が多い疾患のひとつだと思いますし、私も食物アレルギーがありますので、いつかはこういうものが治療されて、安心して今まで食べられなかった物を食べられるようになりたい、と感じます。
短いですが、以上になります。
読んで頂きまして、ありがとうございました!
オプジーボ だけでは がん をやっつけられない
こんにちは、ぷにぷにアザラシです。昨今話題のオプジーボのターゲットタンパクPD-1ですが、今日、こんな論文が出たので紹介します。
背景
今回の主役はがんをやっつける細胞「細胞傷害性 T 細胞」と「PD-1」です。本庶先生のノーベル賞受賞のおかげで、かなり広まりましたね。簡単に述べますと、PD-1を持っている T 細胞は、がん細胞によってPD-1のスイッチを押されるために、がんをやっつけることができなくなる、というのが今までの一般常識でした。だからPD-1のスイッチを押せないようにするオプジーボは、T 細胞のがんをやっつける力を復活させ、それが抗がん作用に結びつくわけですし、今までPD-1を発現したT 細胞は“役立たず”と考えられてきました。
しかし今回の受賞で何回も指摘があったように、オプジーボは全てのガンに奏功するわけではありません。がんにも色々な種類があるからか、というように思われてはいましたが、どうしてそうなるのかはいまいちはっきりとしていませんでした。
今回の発見
今回は乳がんと皮膚がんのサンプルを使って、そこにいるT 細胞を比べています。わかったことは、
- 乳がんの T 細胞も皮膚がんの T 細胞もPD-1を持っている
- 皮膚がん T 細胞は、がんをやっつけるタンパク(サイトカイン)の産生能力が限定されている(1種類しか出せない)のに対して、乳がん T 細胞は少なくとも3種類出せるものが数多くいる
- その結果、乳がん T 細胞は、PD-1を持っているけれども、がんをやっつける能力を保持できている(役立たずではない)
です。つまりは、PD-1が T 細胞の抗がん活性マーカーとして十分ではない、ということをはっきりと示しています。ちなみにこの人たちはさらに検討していて、PD-1に加えて"TIM-3"というタンパクを持っている T 細胞こそが、本当の役立たず T 細胞であると予想しています(乳がん T 細胞ではTIM-3を持っている T 細胞が少ない)。
アザラシの感想・今後
真っ先に誰もが思いつくことは、どうしてPD-1は乳がんでは機能していないのか?ということでしょう。筆者達にも詳しい理由はわからないようです。乳がんの中にも色々な種類があって(エストロゲン受容体(ER)というタンパクや、HER-2というタンパクをもっているかどうか等)、それによって“悪性度”とよばれるがんの強さも変わるのですが、乳がんの一部は昔から T 細胞によって殺されないという性質があるようです。今回の研究に用いた多くのサンプルは 「ERを持っていてHER2を持っていない」T 細胞によって殺されにくい乳がんだったようです。その乳がんのサンプルを使っても、T細胞に細胞を殺す力があったということは、一部の乳がん細胞は、PD-1を介して T 細胞の働きを止めて自分を守るわけではなく、別の方法で何とかして T 細胞の攻撃から我が身を守っているのでしょう。つまりは、オプジーボは効かない、ということをはっきりと示しています。がん細胞が自分の身を守る別の方法が何なのかを見つけることが、今後の課題になりそうです。
以上、ホットなPD-1に関する論文紹介でした!がんって面白いですね!
それでは、最後まで読んで頂きありがとうございました!
